نمک آمونیاک اولین بار توسط جابر بن حیان کشف شد. اولین نفری که آن را ساخت یک شیمیدان انگلیسی بنام جوزف پریستلی بود. پریستلی گاز آمونیاک را درسال 1774 ساخت و اسمش را گاز قلیایی گذاشت. در سال 1785 لوئیس بتوله عناصر تشکیل دهنده آن را شناسایی کرد. در ابتدا آمونیاک از تبخیر سبزیجات نیتروژن دار و فضولات حیوانی بدست می آمد. در سال 1912 فریتز هابر و کارل بوش روش تولید صنعتی این گاز را ابداع نمود. این دو دانشمند با بهبود روش پیشنهادی خود، موفق به دریافت جایزه نوبل شیمی در سالهای 1918 و 1931 گردیدند.
ساختار مولکولی
مولکول آمونیاک متشکل از سه اتم هیدروژن و یک اتم نیتروژن است که با پیوند کووالانسی کنار یکدیگر قرار گرفته اند. فرمول شیمیایی مولکول آن NH3 بوده و شکل مولکول آن به صورت هرمی است. زاویه بین پیوند اتم های هیدروژن مولکول آن 106.7 درجه است. در شکل 1 ساختار مولکولی آن نمایش داده شده است. آمونیاک در آب حل شده محلول آمونیوم هیدروکسید را تشکیل می دهد. در77.7 درجه سلسیوس منجمد و نقطه جوش آن 33.4- درجه سلسیوس است. آمونیاک گازی است بی رنگ و بامزه فوق العاده تند که اشک آور و خفه کننده است. از هوا سبکتر است و به سهولت به مایع تبدیل می شود. وزن مخصوص محلول اشباعی آن در آب 0.88 گرم بر سانتی مکعب می باشد. گاز آمونیاک قابل افروزش و حدود اشتعال آن 25-16 درصد حجمی آن در هوا می باشد. مجاورت و تماس آن با نقره و جیوه تولید فورمینات نقره و جیوه می کند که موادی شدیداً قابل انفجار هستند.
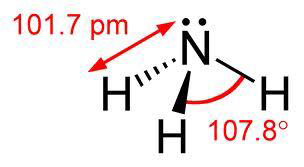
شکل 1: پیوند اتمهای هیدروژن و نیتروژن در ملکول آمونیاک
آمونیاک سبب تحریک دسبتگاه تنفسی ، پوست و چشم شده و به شش ها آسیب می رساند. حد مجاز استنشاق آن 25ppm است و تنفس غلظت ppm 400-700 آن باعث التهاب بینی، چشم و گلو می شود. در مولکول آن، اتم نیتروژن با سه اتم هیدروژن پیوند کووالانسی دارد و یک جفت الکترون آن بدون پیوند مانده است. وجود جفت الکترون ناپیوندی باعث دو قطبی بودن این مولکول شده است.
منابع تولید
به عنوان یک گاز طبیعی با غلظت چند pbb در اتمسفر و جود دارد. قسمت عمده آن موجود در اتمسفر به صورت مستقیم یا غیر مستقیم توسط بشر تولید می شود. طبق آمار منتشر شده سالانه 50 تا 80 تن گاز آمونیاک در سراسر دنیا تولید می شود که کشورهای اروپایی سهم عمده ای در این تولید دارند. سه روش عمده تولید گاز آمونیاک عبارتند از حیوانات اهلی، صنایع شیمیایی و وسایل نقلیه موتوری. قطرات باران و باکتری ها نقش موثری در ورود این گاز در اتمسفر به اکو سیستم دارند. آمونیوم و نمک نیترات از جمله ترکیباتی هستند که به کمک قطرات باران وارد خاک شده و به صورت مولکول آمونیاک به محیط برمی گردند. این فرآیندها سالانه 1 تن از آمونیاک موجود در اتمسفر را تولید می کند. قسمت عمده آن موجود در اتمسفر به دلیل فعالیت های زیستی حیوانات اهلی بوجود می آید. این گاز به دلیل باکتری های موجود در سیستم گوارشی حیوان بوجود می آید و از طریق ادرار وارد محیط می گردد. گاو، گوسفند و خوک از جمله حیوانات اهلی هستند که علاوه بر تولید 20 تا 35 تن از این گاز در سال، مقدار زیادی گاز متان نیز تولید می کنند.
سومین منبع تولید گاز آمونیاک، صنایع شیمیایی و وسایل نقلیه موتوری هستند که سالانه 8.1-2.1 تن از این گاز در سال تولید می کنند. صنایع شیمیایی، گاز آمونیاک را به منظور کاربردهای مختلف تولید می کنند که قسمت عمده آن صرف تهیه کودهای شیمیایی می گردد. یکی دیگر از منابع تولید این گاز دریاها و اقیانوس ها هستند که به دلیل واکنش با باران های قلیایی گاز آمونیاک تولید می کنند.
کاربردهای گاز آمونیاک
آمونیاک دارای کاربرد گسترده ای در صنایع مختلف است که مهمترین آنها به شرح زیر می باشد:
تهیه کود شیمیایی: وسعت عمده آمونیاک تولید شده در جهان صرف تولید کودهای شیمیایی می شود که بصورت نمک آمونیاک، محلول آمونیاک و آمونیاک بی آب به خاک اضافه می گردد. افزودن کودهای شیمیایی به منظور بهبود ترکیبات خاک و افزایش محصولات کشاورزی است.
تهیه اسید نیتریک: اسید نیتریک در تهیه مواد منفجره و محصولات شیمیایی مورد استفاده قرار می گیرد و از اکساید مولکول این گاز بوجود میآید.
تمیز کننده: محلول آمونیوم هیدروکساید به عنوان تمیز کننده سطوح استیل، چینی و شیشه ای مورد استفاده قرار میگیرد. این محلول متشکل از 5 تا 10 درصد آمونیاک حل شده در آب است.
صنایع غذایی: در خط تولید و بسته بندی صنایع غذایی، محلول آمونیوم هیدروکسید به عنوان ماده ضد باکتری مورد استفاده قرار می گیرد. غلظت آمونیاک مصرفی، تحت کنترل بوده و حد مجاز آن برای سمت مصرف کننده در نظر گرفته می شود.
سیستم های برودتی : به دلیل ویژگی های بار آمونیاک، از آن به عنوان یک گاز خنک کننده کم هزینه و با بهره بالا استفاده می شود..
گاز بالا برنده: در دما و فشار ایده ال، چگالی گاز آمونیاک از اتمسفر کمتر است و قدرت بالا برندگی آن در حدود 60 درصد کمتر از قدرت گازهای هیدروژن و هلیوم می باشد. با این حال به عنوان گاز بالا برنده بالون ها قابل استفاده می باشد.
نجاری: چوب در واکنش با مولکول این گاز تغییر رنگ می دهد. بنابراین در بسیاری از کارهای زینتی و برای ایجاد طرح بر روی چوب، آن را در مجاورت این گاز قرار می دهند.
منابع:
1-G. C. Miler, “Ammonia,” J. Chem. Educ, vol. 58, no. 4, p. 424, 1981.






ثبت ديدگاه